来源:人民日报 时间:2013-02-28 12:24:50 热度:1249 播放
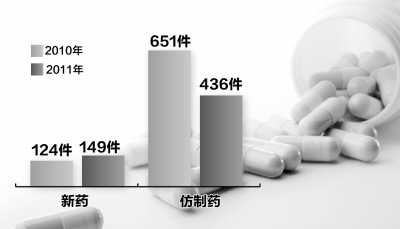
我国批准境内药品注册申请情况
数据来源:药品注册审批年度报告
国家食品药品监管局日前发布《关于深化药品审评审批改革进一步鼓励创新的意见》(以下简称《意见》),通过调整药品审评审批策略,鼓励具有临床价值药物的创新和儿童药物的研制。国家食品药品监管局药品注册司司长王立丰对意见进行了解读。
王立丰说,此次改革更加注重以临床需求为导向,鼓励有临床需求、具有较好治疗作用,具有自主知识产权的创新药物研制,并对这些药物将加快审评。
同时,遵循创新药物研发规律,营造更好的创新环境。王立丰说,以往新药注册要求在申报时就提供完整的剂型、规格、工艺甚至质量标准等资料,而且不可变更。现在则可以根据研发进展,逐渐探索、逐步明确,阶段性增补、变更和完善申报资料,在创新药申报生产时才要求提供上述完整资料。
《意见》确定仿制药优先审评领域。属于临床供应不足、市场竞争不充分、影响公众用药可及性和可负担性的药品,儿童用药、罕见病用药和特殊人群用药,以及其他经评估确认为临床急需的药品,实行优先审评。“这样可以减少资源浪费和重复申报,引导申请人理性申报,不再将有限的审评资源浪费在重复申报的品种审评上。”王立丰说。
同时,对仿制药优先审评领域试点流程进行优化。在不降低技术标准的前提下,简化不必要的行政程序,针对优先审评的仿制品种,探索实施生物等效性试验备案制管理。备案后,临床试验机构即可开展试验。对优先审评的仿制药,通过单独排序、调整生产现场检查检验程序、优化审评流程,提高审评效率。
目前缺乏儿童专用药品已经成为全世界范围内的共性问题。即使是在药品研发、生产、监管水平都很高的美国,也有超过75%的药品没有儿童用药信息。
《意见》专门就儿童药物研发提出鼓励措施,是此次改革的突破之一。一是鼓励企业开发适于不同年龄段儿童使用的剂型和规格的药品,切实加快我国儿童用药品的研发和上市速度,鼓励创新药申报时一并申报儿童剂型和规格。针对儿童特殊疾病、罕见病研究开发的创新药,纳入特殊审批程序。仿制药的儿童用规格和剂型申请,可以优先受理和审评。二是积极开展儿童药管理的政策研究。组织相关技术单位、医疗机构、科研院校和药品企业的药品、医疗和法律专家就儿童药的研发、注册审评、临床试验管理等方面进行专题讨论和研究。三是会同有关部门研究儿童用药在招标、定价、医保等方面的综合鼓励措施。富子梅
(责任编辑:秋彤)
2026-02-01
2026-02-01
2026-02-01
2026-01-31
2026-01-31
2026-01-30